Sievert a diagram ekvivalentní dávky záření
 Násobky a díly jednotek používaných denodenně si docela dokážeme představit. Tušíme kolik je kilometr, decimetr, centimetr, milimetr...Horší to je bude s jednotkami a jejich díly, které si ani představit nedokážeme. Projevilo se to v době rozšíření radioaktivity z japonské elektrárny Fukušima až k nám do České republiky. Přitom panika není na místě. Naměřené hodnoty radioaktivity jsou natolik směšné, že si to v nedokážeme ani porovnat s běžnou přirozenou radioaktivitou způsobenou například radonem. A tak se do boje za lepší představu radioaktivity a jejich účinků vydal kreslíř komiksů Randall Munroe. Autor komiksu xkcd.com, nakreslil úžasný diagram srovnávající hodnoty radiace.
Násobky a díly jednotek používaných denodenně si docela dokážeme představit. Tušíme kolik je kilometr, decimetr, centimetr, milimetr...Horší to je bude s jednotkami a jejich díly, které si ani představit nedokážeme. Projevilo se to v době rozšíření radioaktivity z japonské elektrárny Fukušima až k nám do České republiky. Přitom panika není na místě. Naměřené hodnoty radioaktivity jsou natolik směšné, že si to v nedokážeme ani porovnat s běžnou přirozenou radioaktivitou způsobenou například radonem. A tak se do boje za lepší představu radioaktivity a jejich účinků vydal kreslíř komiksů Randall Munroe. Autor komiksu xkcd.com, nakreslil úžasný diagram srovnávající hodnoty radiace.
Situace v jaderné elektrárně Fukušima
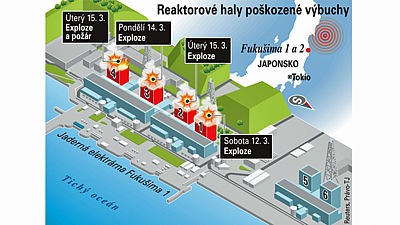 Po ničivém zemětřesení se na severovýchodním pobřeží Japonska vzniklá vlna tsunami přehnala přes ochrannou zeď elektrárny Fukušima 1 a vyřadila z provozu elektrické napájení reaktorů i záložní agregáty. Do chladícího systému jednotlivých reaktorů přestala proudit chladící kapalina a první čtyři reaktory Fukušimy se začaly nebezpečně přehřívat. Voda ze systému se postupně vypařovala, palivové tyče se přehřívaly a začal se tavit jejich obal ze slitiny zirkonia. V reakci s párou začal vznikat vodík. Když se technici snažili tento plyn odvést z tlakové nádoby, došlo k výbuchu, který poničil budovu reaktoru. Začaly vznikat požáry, docházelo k částečnému tavení vnitřního ochranného obalu reaktoru a následným únikům radioaktivní páry. Ve 20 km okolí elektrárny proběhla evakuace obyvatel.
Po ničivém zemětřesení se na severovýchodním pobřeží Japonska vzniklá vlna tsunami přehnala přes ochrannou zeď elektrárny Fukušima 1 a vyřadila z provozu elektrické napájení reaktorů i záložní agregáty. Do chladícího systému jednotlivých reaktorů přestala proudit chladící kapalina a první čtyři reaktory Fukušimy se začaly nebezpečně přehřívat. Voda ze systému se postupně vypařovala, palivové tyče se přehřívaly a začal se tavit jejich obal ze slitiny zirkonia. V reakci s párou začal vznikat vodík. Když se technici snažili tento plyn odvést z tlakové nádoby, došlo k výbuchu, který poničil budovu reaktoru. Začaly vznikat požáry, docházelo k částečnému tavení vnitřního ochranného obalu reaktoru a následným únikům radioaktivní páry. Ve 20 km okolí elektrárny proběhla evakuace obyvatel.
Změny relativní atomové hmotnosti některých prvků
 Pro posouzení klidové hmotnosti atomů byla zavedena relativní atomová hmotnost, která udává kolikrát je hmotnost jistého atomu větší než stanovená referenční hmotnost vybraného atomu. Nejmenším atomem je atom vodíku, a tak relativní atomová hmotnost přibližně udává kolikrát je atom těžší než atom vodíku 1H1, který má ve svém jádře pouze jeden proton. Jenže vodík má v přírodě více izotopů a tak se místo něj stal referenčním atomem kyslík. Přesněji šlo o stanovení hodnoty 1/16 hmotnosti atomu kyslíku 8O16. Nakonec si vědci vybrali izotop uhlíku 6C12 a zjistili hmotnost 1/12 tohoto atomu. Tak vznikla atomová hmotnostní konstanta mu = 1,66 . 10-27 kg. Vynásobením této hodnoty relativní atomovou hmotností Ar daného chemického prvku získáme hmotnost atomu daného prvku. Relativní atomová hmotnost je tedy podílem klidové hmotnosti atomu a atomové hmotnostní konstanty mu. V tabulkách jsou uváděny střední hodnoty Ar, neboť prvky se v přírodě vyskytují ve formě směsi izotopů. A u některých chemických prvků nyní dojde ke zpřesnění relativní atomové hmotnosti.
Pro posouzení klidové hmotnosti atomů byla zavedena relativní atomová hmotnost, která udává kolikrát je hmotnost jistého atomu větší než stanovená referenční hmotnost vybraného atomu. Nejmenším atomem je atom vodíku, a tak relativní atomová hmotnost přibližně udává kolikrát je atom těžší než atom vodíku 1H1, který má ve svém jádře pouze jeden proton. Jenže vodík má v přírodě více izotopů a tak se místo něj stal referenčním atomem kyslík. Přesněji šlo o stanovení hodnoty 1/16 hmotnosti atomu kyslíku 8O16. Nakonec si vědci vybrali izotop uhlíku 6C12 a zjistili hmotnost 1/12 tohoto atomu. Tak vznikla atomová hmotnostní konstanta mu = 1,66 . 10-27 kg. Vynásobením této hodnoty relativní atomovou hmotností Ar daného chemického prvku získáme hmotnost atomu daného prvku. Relativní atomová hmotnost je tedy podílem klidové hmotnosti atomu a atomové hmotnostní konstanty mu. V tabulkách jsou uváděny střední hodnoty Ar, neboť prvky se v přírodě vyskytují ve formě směsi izotopů. A u některých chemických prvků nyní dojde ke zpřesnění relativní atomové hmotnosti.
Miniaturní městský atomový reaktor
 Malý jaderný reaktor může mít výkon kolem 25 MW a tímto výkonem může pokrýt spotřebu malého města. Toto řešení nabízí americká společnost Hyperion, která plánuje jeho výrobu do 5 let. Cena první série se zatím pohybuje kolem 100 milionů dolarů, ale nezahrnuje některé další komponenty jako např. parní turbínu. Model tohoto reaktoru se objevil i na českém webu. Jeho princip však není nijak převratný a příliš se neliší od principu klasické atomové elektrárny.
Malý jaderný reaktor může mít výkon kolem 25 MW a tímto výkonem může pokrýt spotřebu malého města. Toto řešení nabízí americká společnost Hyperion, která plánuje jeho výrobu do 5 let. Cena první série se zatím pohybuje kolem 100 milionů dolarů, ale nezahrnuje některé další komponenty jako např. parní turbínu. Model tohoto reaktoru se objevil i na českém webu. Jeho princip však není nijak převratný a příliš se neliší od principu klasické atomové elektrárny.
Zpozorován pohyb elektronů v atomech
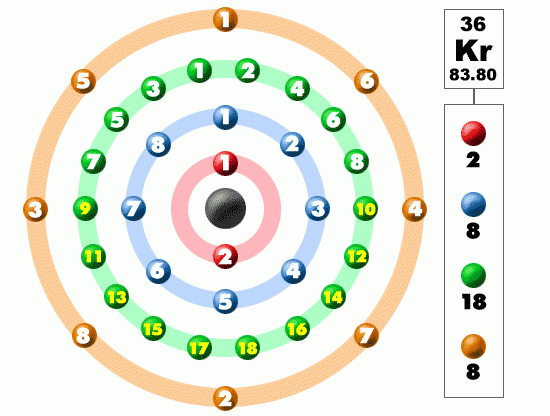 Elektron je elementární částicí a protože se nachází v obalu atomu, má velký vliv na chemické vlastnosti atomu. Představa elektronu jako kroužícího objektu kolem atomového jádra ve srovnání s planetami obíhajícími kolem Slunce vzala dávno zasvé. Elektron je vůbec podivuhodná částice mikrosvěta a své podivuhodné vlastnosti projeví zejména v experimentech s dvojštěrbinou. Podle kvantové teorie se elektrony vyskytují s největší pravděpodobností v oblastech nazývaných orbitaly, které jsou dány elektronovou konfigurací obalu atomu. Jednotlivé orbitaly neurčují přesně polohu elektronu, ale pouze největší pravděpodobnost jeho výskytu. Zachytit pohyb elektronů v atomech se nyní podařilo týmu amerických a německých vědců.
Elektron je elementární částicí a protože se nachází v obalu atomu, má velký vliv na chemické vlastnosti atomu. Představa elektronu jako kroužícího objektu kolem atomového jádra ve srovnání s planetami obíhajícími kolem Slunce vzala dávno zasvé. Elektron je vůbec podivuhodná částice mikrosvěta a své podivuhodné vlastnosti projeví zejména v experimentech s dvojštěrbinou. Podle kvantové teorie se elektrony vyskytují s největší pravděpodobností v oblastech nazývaných orbitaly, které jsou dány elektronovou konfigurací obalu atomu. Jednotlivé orbitaly neurčují přesně polohu elektronu, ale pouze největší pravděpodobnost jeho výskytu. Zachytit pohyb elektronů v atomech se nyní podařilo týmu amerických a německých vědců.
Radiouhlíková metoda určování stáří

K datování organických zbytků využívají archeologové radiouhlíkovou metodu. Je založena na tom, že uhlík v přírodě je směsí tří izotopů. Dva z nich jsou stabilní: C12 a C13 a ten, který nás nyní zajímá, je radioaktivní izotop C14. Poměr těchto tří izotopů je dlouhodobě konstantní, protože izotop C14 je neustále v atmosféře doplňován srážkami neutronů kosmického záření s dusíkem v atmosféře. Během života organismu je přijímán izotop C14 do organismu dýcháním, potravou a jinou formou. Po odumření organismu přísun tohoto izotopu ustává. Původní poměr mezi třemi izotopy uhlíku v organických zbytcích se začíná měnit a dochází během času k rozpadu uhlíku C14. Vyzařuje přitom částici beta a mění se na izotop dusíku N14. Radioaktivní uhlík má poločas přeměny 5730 let, což je právě doba vhodná na určování stáří organismů.
Prvek se 117 protony v jádře připraven
 Ještě před 60 lety nebyly v periodické soustavě prvků prvky s protonovým číslem větším než 100. Nikdo nevěřil, že by mohly být připraveny, když jejich poločasy přeměny by měly být ve zlomcích sekundy. Mezitím se rodina supertěžkých prvků s jepičí dobou života postupně rozrůstá. Jako poslední prvek se zatím podařilo připravit několik jader prvku s protonovým číslem 117.
Ještě před 60 lety nebyly v periodické soustavě prvků prvky s protonovým číslem větším než 100. Nikdo nevěřil, že by mohly být připraveny, když jejich poločasy přeměny by měly být ve zlomcích sekundy. Mezitím se rodina supertěžkých prvků s jepičí dobou života postupně rozrůstá. Jako poslední prvek se zatím podařilo připravit několik jader prvku s protonovým číslem 117.
Vodíková bomba
V 50-tých letech 20. století přišel na svět nový typ bomby. Jejími konstruktéry byli Stanislav Marcin Ulam a Edward Teller. Známá je jako termojaderná bomba nebo také vodíková bomba. Pracuje na stejném principu jako procesy probíhající uvnitř hvězd, kde se za velkých tlaků a teplot slučují jádra vodíku na jádra helia a následně dál na jádra jiných prvků. Uvolňuje se přitom obrovské množství energie, která ohřeje nitra hvězd na stovky milionů stupňů Celsia.
Jak si zapamatovat periodickou soustavu prvků?
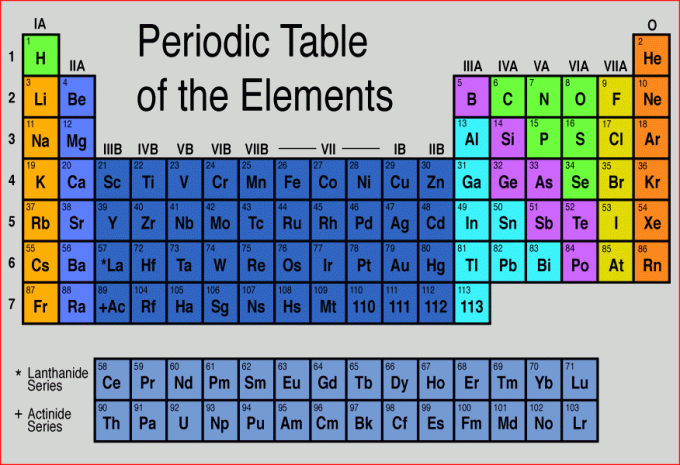
I fyzikům není naškodu, když si pamatují periodickou soustavu prvků, pokud ji zrovna nemají u sebe k dispozici. Slouží k tomu řada zlidovělých mnemotechnických pomůcek, kdy počáteční písmena slov začínají stejně jako značka chemického prvku. Tak pokud je ještě neznáte nebo neumíte, zde je jejich přehled:
Röntgen - 165. výročí narození
 Dnes uplynulo 165 let od narození prvního nositele Nobelovy ceny za fyziku Wilhelma Conrada Röntgena. Narodil se v kupecké rodině dne 27. března 1845 v Lennep v Prusku. V jeho třech letech se rodina přestěhovala do nizozemského Apeldoornu. Rontgen studoval v Utrechtu technickou školu, vynikal v technických oborech, ale i v angličtině nebo francouzštině. Přesto svá studia zde nedokončil.
Dnes uplynulo 165 let od narození prvního nositele Nobelovy ceny za fyziku Wilhelma Conrada Röntgena. Narodil se v kupecké rodině dne 27. března 1845 v Lennep v Prusku. V jeho třech letech se rodina přestěhovala do nizozemského Apeldoornu. Rontgen studoval v Utrechtu technickou školu, vynikal v technických oborech, ale i v angličtině nebo francouzštině. Přesto svá studia zde nedokončil.