Proč se izolepa při odmotávání zužuje?
 Při odmotávání izolepy se stává, že se tenká izolepa při odvíjení začne ztenčovat do trojúhelníkové špičky až se nakonec přetrhne. Toto zajímavé chování můžeme pozorovat i při dalších dějích, jako například odtrhávání papírové etikety nalepené na sklenici či plechovce. Dokonce i při loupání rajčete můžeme pozorovat, že je odtrhávaná slupka tím užší, čím je méně pružný materiál a čím rychleji slupku strháváme. Nakonec se stejně přetrhne.
Při odmotávání izolepy se stává, že se tenká izolepa při odvíjení začne ztenčovat do trojúhelníkové špičky až se nakonec přetrhne. Toto zajímavé chování můžeme pozorovat i při dalších dějích, jako například odtrhávání papírové etikety nalepené na sklenici či plechovce. Dokonce i při loupání rajčete můžeme pozorovat, že je odtrhávaná slupka tím užší, čím je méně pružný materiál a čím rychleji slupku strháváme. Nakonec se stejně přetrhne.
Největší přírodní krystaly na světě
 Pokud jste si zkoušeli vyrobit krystalky soli odpařováním solného roztoku, tak se vám nepodařilo běžně vyrobit krystalky větší než 1 cm. Matka příroda je v tomto směru obdivuhodná. V jejich útrobách se skrývají neskutečné poklady. Jeden z nich představuje snad největší přírodní krystaly na světě. Nádherné, ale zato smrtelné.
Pokud jste si zkoušeli vyrobit krystalky soli odpařováním solného roztoku, tak se vám nepodařilo běžně vyrobit krystalky větší než 1 cm. Matka příroda je v tomto směru obdivuhodná. V jejich útrobách se skrývají neskutečné poklady. Jeden z nich představuje snad největší přírodní krystaly na světě. Nádherné, ale zato smrtelné.
Proč mají skvrny od kávy tmavé okraje?
 Občas se stane, že na kuchyňskou desku či stůl ukápne nějaká ta kapka. A pokud ji nestačíme utřít, můžeme pozorovat vznik zajímavé skvrny. Výzkumem skvrn od rozlité kávy se zabývají i fyzikové. Přivedl je k tomu konečný výsledek odpaření vody. Vytvoří se hnědá skvrna s téměř prázdným středem. Jak to, že při odpařování vody se dostane v něm rozpuštěná káva na okraj skvrny a ne naopak?
Občas se stane, že na kuchyňskou desku či stůl ukápne nějaká ta kapka. A pokud ji nestačíme utřít, můžeme pozorovat vznik zajímavé skvrny. Výzkumem skvrn od rozlité kávy se zabývají i fyzikové. Přivedl je k tomu konečný výsledek odpaření vody. Vytvoří se hnědá skvrna s téměř prázdným středem. Jak to, že při odpařování vody se dostane v něm rozpuštěná káva na okraj skvrny a ne naopak?
Co umí kapilární tlak - pokus se 2 bublinami
 Pokud vyfoukneme pomocí trychtýře namočeného koncem do saponátového roztoku bublinu a ústí trychtýře nasměrujeme například k hořící svíčce, bude se její plamínek odklánět od ústí trychtýře. Z bubliny je vytlačován vzduch, což je důkaz většího tlaku vzduchu v bublině než okolního atmosférického tlaku. Tento přídavný tlak v kapalině způsobuje zajímavý výsledek pokusu s dvěmi bublinami rozdílných průměrů, které vyfoukneme na opačných koncích skleněné trubičky a oddělíme trojcestným kohoutem. Co se stane s bublinami, když je pomocí kohoutu spojíme? Přefoukne se skutečně větší bublina do malé?
Pokud vyfoukneme pomocí trychtýře namočeného koncem do saponátového roztoku bublinu a ústí trychtýře nasměrujeme například k hořící svíčce, bude se její plamínek odklánět od ústí trychtýře. Z bubliny je vytlačován vzduch, což je důkaz většího tlaku vzduchu v bublině než okolního atmosférického tlaku. Tento přídavný tlak v kapalině způsobuje zajímavý výsledek pokusu s dvěmi bublinami rozdílných průměrů, které vyfoukneme na opačných koncích skleněné trubičky a oddělíme trojcestným kohoutem. Co se stane s bublinami, když je pomocí kohoutu spojíme? Přefoukne se skutečně větší bublina do malé?
Boj s námrazou na letadlech
 Pro současný letecký provoz a to nejenom v zimním období zůstává problémem tvorba námrazy na povrchu letadel. Námraza totiž způsobuje výrazné zhoršení aerodynamických vlastností letadla - výrazně se mění profil křídel a ocasních ploch, což má za následek menší vztlak, ztrátu rychlosti či mnohem vyšší spotřebu pohonných hmot. Také může docházet za letu k odlupování ledu a jeho následnému nasátí do motoru letadla. Velká námraza na letadle mění rovněž jeho těžiště, tím i stabilitu celého stroje. Na navigačních čidlech námraza může zapříčinit jejich nesprávnou činnost a zkreslit získaná data. S námrazou na letadlech se bojuje nejrůznějšími způsoby.
Pro současný letecký provoz a to nejenom v zimním období zůstává problémem tvorba námrazy na povrchu letadel. Námraza totiž způsobuje výrazné zhoršení aerodynamických vlastností letadla - výrazně se mění profil křídel a ocasních ploch, což má za následek menší vztlak, ztrátu rychlosti či mnohem vyšší spotřebu pohonných hmot. Také může docházet za letu k odlupování ledu a jeho následnému nasátí do motoru letadla. Velká námraza na letadle mění rovněž jeho těžiště, tím i stabilitu celého stroje. Na navigačních čidlech námraza může zapříčinit jejich nesprávnou činnost a zkreslit získaná data. S námrazou na letadlech se bojuje nejrůznějšími způsoby.
Ostrost a křehkost keramického nože
 Hitem letošních Vánoc v kuchyni se může stát keramický nůž. Marketingové reklamní akce prodejců slibují jeho nadpřirozené schopnosti. Takový nůž se nemusí brousit, je lehký, snadno omyvatelný, nepřilnavý, při krájení ovoce nedochází k jeho zašpinění od šťávy a hlavně k ničení lidstvem oblíbeného vitamínu C. Čepel nože je odolná proti korozi a jídlo nechytí žádnou kovovou pachuť nebo nádech. Jídlo nakrájené tímto keramickým nožem si udrží svoji originání chuť a svěžest. Kupující by však měl vědět i jeho nevýhody.
Hitem letošních Vánoc v kuchyni se může stát keramický nůž. Marketingové reklamní akce prodejců slibují jeho nadpřirozené schopnosti. Takový nůž se nemusí brousit, je lehký, snadno omyvatelný, nepřilnavý, při krájení ovoce nedochází k jeho zašpinění od šťávy a hlavně k ničení lidstvem oblíbeného vitamínu C. Čepel nože je odolná proti korozi a jídlo nechytí žádnou kovovou pachuť nebo nádech. Jídlo nakrájené tímto keramickým nožem si udrží svoji originání chuť a svěžest. Kupující by však měl vědět i jeho nevýhody.
Osmotická elektrárna
Kromě řady tepelných, jaderných, vodních, slunečních, větrných, geotermálních, příbojových elektráren a dalších druhů netradičních elektráren, spatřil v Norku světlo světa i první prototyp osmotické elektrárny. Tato elektrárna vyrábí elektřinu mícháním slané a sladké vody v ústích řek přes speciální membránu. Přitom se uvolňuje poměrně velké množství dosud nevyužívané energie
Smrt žízní - osmotický tlak
 Trosečník plující na prámu na volném moři může zemřít žízní. Kolem sebe má sice moře vody, ale ta je slaná. Proč slaná voda neuhasí jeho žízeň?
Trosečník plující na prámu na volném moři může zemřít žízní. Kolem sebe má sice moře vody, ale ta je slaná. Proč slaná voda neuhasí jeho žízeň?
Jak se přišlo na hodnotu Avogadrovy konstanty?
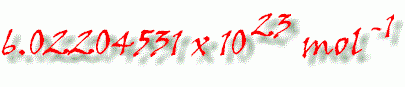
Avogadrova konstanta (nesprávně označována jako Avogadrovo číslo) je konstanta udávající počet molekul, popřípadě jiných částic, v látkovém množství jeden mol. Značí se NA.
Na počátku 19. století John Dalton, Joseph Louis Gay-Lussac a Amedeo Avogadro došli na základě výsledků svých výzkumů k závěru, že látka má částicovou strukturu. Rozborem Gay-Lussacova zákona dospěl v roce 1811 Avogadro k zákonu označovaném Avogadrův zákon, že stejné objemy různých plynů obsahují za stejného tlaku a stejné teploty stejný počet molekul. Ačkoliv Avogadrova konstanta nese jméno italského fyzika Amedea Avogadra tak sám Avogadro její číselnou hodnotu ještě neznal. Avogadrova konstanta se totiž určuje experimentálně a tudíž ji nemůžeme znát s absolutní přesností. Hodnotu Avogadrovy konstanty poprvé odhadl v roce 1865 rakouský chemik původem z Čech Johann Loschmidt z kinetické teorie interpretace viskozity zředěného plynu. Loschmidt chtěl učit rozměry molekul tak, že porovnával hustotu látky v kapalném a plynném skupenství. Předpokládal přitom, že molekuly jsou tvaru koulí a v kapalném skupenství jsou k sobě těsněji uspořádány. Tady mu však k vyjádření výsledku chyběla další hodnota, a proto měřil střední volnou dráhu molekul v plynu (průměrnou vzdálenost každých dvojic molekul plynu před jejich srážkou) tak, že stanovil dynamickou viskozitu (vnitřní tření) plynu. Jeho odhad průměru molekul byl 3.10–10 m a rovněž solidně odhadl, že v m3 vzduchu je 2,0 . 1025 molekul.
Kousání do zlata
Některé situace dnes již běžně nezažijeme. Představte si, že by například pokladní v obchodě testovala pravost mincí, kterými platíte, svým chrupem. Přitom dříve to byla jedna z primitivních metod, jak poznat pravost zlatých mincí. Pokud byste tehdy obdrželi zlatou minci, tak po prozkoumání zrakem by jste ji otestovali skousnutím mezi svými zuby. Co tím ale zjistíte?